Estudio muestra composición alterada por biorritmos nutricionales

La microbiota intestinal se ha relacionado con una amplia gama de procesos biológicos que benefician al huésped, incluidas las condiciones nutricionales y el sistema inmunitario. La composición de la microbiota cambia drásticamente en respuesta a las condiciones ambientales y biológicas. La alternancia de la composición de la microbiota afecta la absorción nutricional y la regulación del equilibrio energético del huésped, y se han reportado interacciones entre el huésped y la microbiota intestinal causadas por condiciones dietéticas en muchos animales, incluidos los peces. Además, el ciclo de alimentación y ayuno involucra tanto el metabolismo del huésped como la composición del microbioma intestinal, y podría conducir a la obesidad y a las enfermedades metabólicas.
También se ha demostrado que la microbiota intestinal cambia de acuerdo con el ritmo circadiano (un proceso interno natural que regula el ciclo sueño-vigilia, que se repite aproximadamente cada 24 horas) debido al vínculo con el ritmo circadiano del huésped. El conocimiento sobre la microbiota intestinal de los peces teleósteos (con aletas radiadas) se ha ido acumulando gradualmente; sin embargo, la información sobre la dinámica y la interacción con los peces hospedadores sigue siendo limitada y parece diferir según la condición y la especie.
Este artículo, adaptado y resumido de la publicación orginal, informa sobre un estudio para caracterizar la composición del microbioma intestinal del mero leopardo de coral e investigar la dinámica del microbioma desde las condiciones de ayuno hasta las condiciones de alimentación. La capacidad funcional de la microbiota se estimó posteriormente y se comparó con el transcriptoma del huésped (el conjunto de todas las moléculas de ARN en una célula o una población de células) y el metaboloma (el conjunto completo de productos químicos de molécula pequeña encontrados dentro de una muestra biológica). Nuestro análisis sugiere la organización del metabolismo de huésped del mero leopardo de coral y su metabolismo de microbiota.
Configuración del estudio
Meros leopardo de coral de ocho meses de edad (cada uno de aproximadamente 60 gramos de peso) se mantuvieron en tanques de 60,000 litros con un sistema de flujo a través en el Laboratorio Yaeyama, Instituto Nacional de Investigación Pesquera de Seikai, Agencia de Investigación Pesquera en Japón. La instalación estaba iluminada por la luz solar con un fotoperíodo natural (11 L: 13 D) durante el invierno. Los peces estuvieron en ayunas durante los primeros dos días del experimento y luego fueron alimentados [tiempo de Zeitgeber (ZT) 2 y ZT10] a saciedad durante los siguientes dos días experimentales.
Los peces fueron alimentados con un alimento comercial para peces (Higashimaru Co., LTD .; Kagoshima, Japón) con> 46 por ciento de proteína,> 10 por ciento de grasa, <15 por ciento de carbohidratos, <2.5 por ciento de fibra,> 2.0 por ciento de calcio y> 1.0 por ciento de fósforo.
El contenido del tracto intestinal se recolectó cada 4 horas, excepto durante la noche del día 1 y el día 3. En cada punto de muestreo, se tomaron muestras de tres a doce peces individualmente. Se recogieron muestras de agua de mar desde el exterior de la instalación (agua de mar costera), la entrada, el tanque de cría y la salida cada 12 horas (ZT2 y ZT12). Se recogieron muestras de moco de la piel de seis peces en ZT10 del día 2 (en ayunas) y el día 4 (alimentación). Las muestras se recolectaron y almacenaron congeladas hasta que se usaron para experimentos.
Para obtener información detallada sobre cría y muestreo de peces, extracción de ADN y construcción de bibliotecas de ADN, secuenciación y análisis de datos, consulte la publicación original.
Resultados y discusión
La comunidad de microbiota fue investigada en condiciones de ayuno y alimentación. Las proteobacterias fueron el phylum dominante durante el ayuno (Fig. 1A), así como en el agua de mar en los tanques de cría. Después de la alimentación, Firmicutes se convirtió en el phylum dominante. Como los peces fueron alimentados en ZT2 y ZT18 desde el día 3 y el phylum dominante había cambiado por ZT14 en el día 3, el phylum dominante tardó aproximadamente 12 horas en intercambiarse.
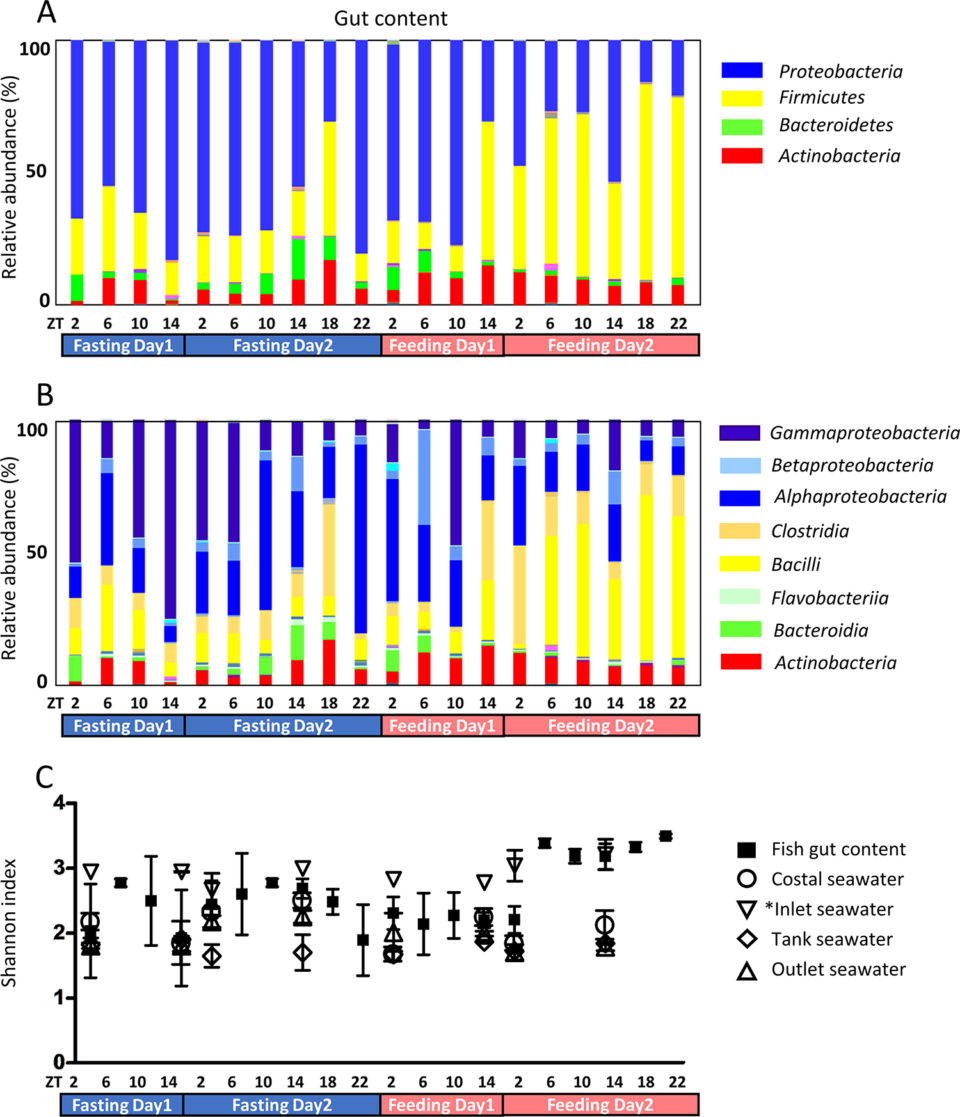
Durante el ayuno, las gammaproteobacterias fueron dominantes, probablemente provenientes del agua de mar ingerida (Fig. 1B). Los peces beben agua de mar para compensar la deshidratación. En la mayoría de los casos, se ha informado que las gammaproteobacterias son dominantes en los tanques de cría; la piel y el intestino de los peces, tanto del mar como de los tanques de cría, son ricos en gammaproteobacterias.
En nuestro estudio, las gammaproteobacterias fueron la clase más dominante en el tanque de cría de agua de mar y moco de la piel y la proporción de Firmicutes y Actinobacterias fue mayor en el agua de mar de entrada que en otras aguas de mar. Como el agua de mar de entrada fue sometida a esterilización UV, la composición de la microbiota parece haber cambiado. La abundancia de microbiota también fue significativamente baja debido a la esterilización. La microbiota en el intestino de los peces cambió después de la alimentación (ZT14 del día 3) y la composición de la microbiota en el agua de mar del tanque de cría cambió simultáneamente, lo que sugiere que el agua de mar del tanque se ve afectada por las condiciones de alimentación de los peces.
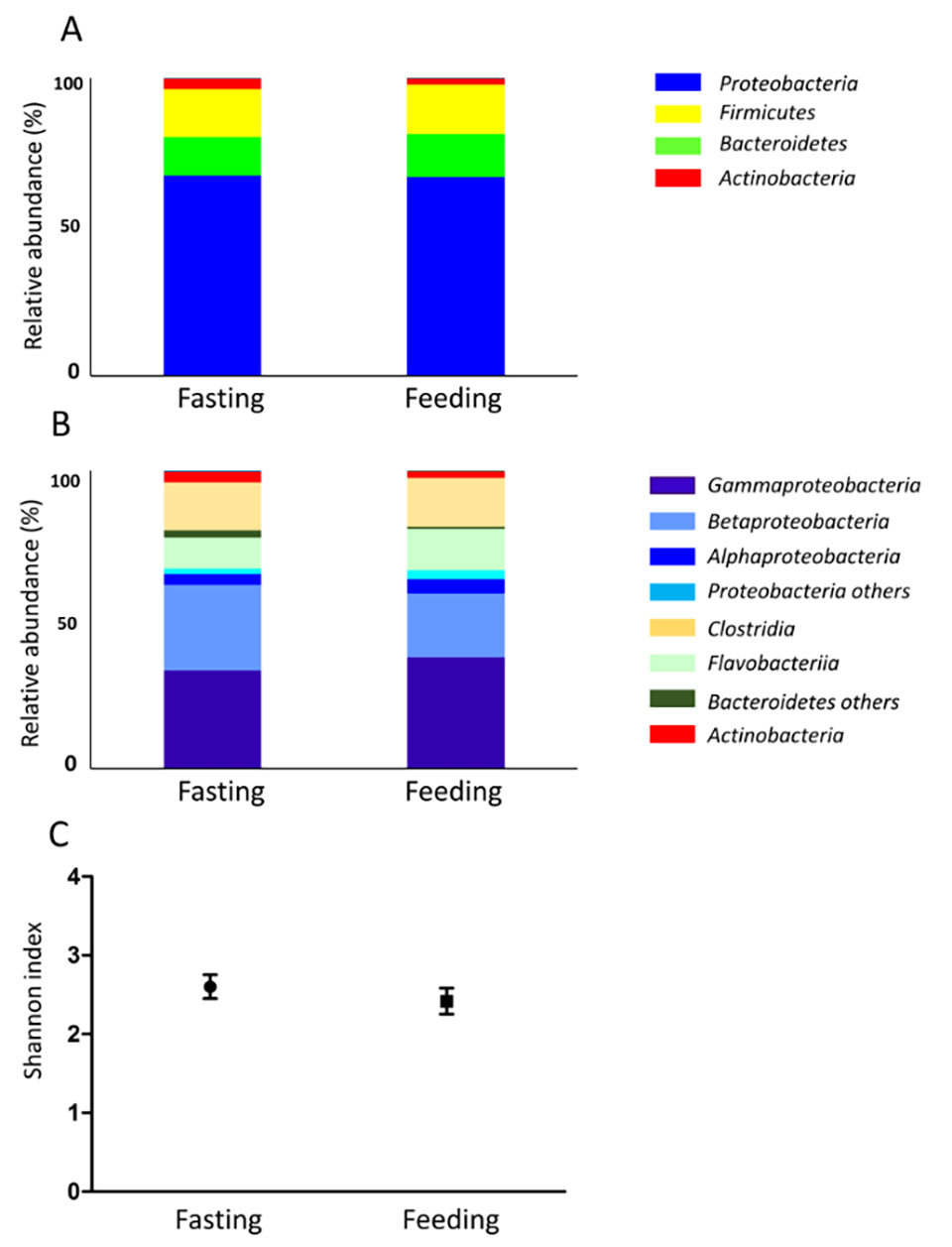
También se investigó la microbiota del moco de la piel (Fig. 2). El contenido intestinal en ayunas se compone casi por completo de moco; por lo tanto, la microbiota mucosa de la piel y la microbiota intestinal en ayunas fueron similares. La biodiversidad de la microbiota intestinal fue mayor después del día 2 de alimentación en comparación con los otros puntos temporales experimentales (Fig. 1C). En las muestras de agua de mar, la biodiversidad no cambió durante el experimento, mientras que la biodiversidad del moco de la piel disminuyó ligeramente durante el período de ayuno. Las condiciones de alimentación pueden afectar no solo el tracto digestivo, sino todo el cuerpo.
A medida que la composición de la microbiota cambia en respuesta a las condiciones de alimentación y ayuno, también podría afectar la condición nutricional del huésped, y se presume que la microbiota intestinal interactúa con el pez huésped. La alternancia de la composición de microbiota afecta la absorción nutricional y la regulación del equilibrio energético del huésped. Aunque la microbiota intestinal no exhibió oscilación diurna en nuestro estudio, nuestros resultados muestran que la composición de la microbiota de los peces cambió en dos días según las condiciones nutricionales.
La diversidad filogenética cambió según las condiciones de alimentación (Fig. 1C). El índice se elevó después de F4-ZT6 (día de alimentación 2, ZT 6), mientras que la población bacteriana aumentó después de aproximadamente 24 horas. Se ha observado una tendencia similar de la diversidad filogenética en condiciones de ayuno en la tilapia. También se ha informado que la diversidad filogenética cambia entre peces silvestres y de granjas. En comparación con el contenido intestinal, la diversidad filogenética del agua de mar era baja. Se cree que la microbiota intestinal es compleja para cumplir las funciones de simbiosis.
El análisis jerárquico de clusters (HCA; un algoritmo que agrupa objetos similares en grupos llamados clusters) reveló tres grupos: 1) alto durante el ayuno, 2) alto durante la alimentación y 3) otros. Proteobacterias y Bacteroidetes pertenecen al grupo de ayuno, mientras Firmicutes y Fusobacterias pertenecen al grupo de alimentación.
El análisis de correlación posterior reveló que Firmicutes y Fusobacteria exhibieron una correlación positiva, mientras que Firmicutes y Bacteroidetes mostraron una correlación negativa. Se ha establecido ampliamente que Firmicutes aumenta bajo condiciones de alto consumo de alimento graso, y que Firmicutes y Bacteroidetes exhiben una correlación negativa. Aunque estos informes examinaron mamíferos, los peces también han exhibido una relación similar entre Firmicutes y Bacteroidetes. Nuestro estudio anterior mostró que los peces de cultivo almacenan cantidades excesivas de grasa visceral. Se cree que este exceso de grasa se origina en el alimento; por lo tanto, se predice que el número de Firmicutes aumentará.
Investigamos la dinámica de la microbiota intestinal desde el ayuno hasta la alimentación. Se predice que las bacterias dominantes durante el ayuno se originan en el agua de mar ambiental. Después de la alimentación, la composición de la microbiota cambió gradualmente y alcanzó el tipo de condición de alimentación 12 horas desde el inicio de la alimentación. Nuestro análisis identificó las siguientes bacterias clave: Firmicutes y Fusobacterias para las condiciones de alimentación, y Proteobacterias para las condiciones de ayuno. Las gammaproteobacterias fueron la clase dominante de Proteobacterias en el agua de mar ambiental, que es diferente del agua de mar natural. Se ha informado que las gammaproteobacterias se enriquecen en el moco, la piel y el intestino de los peces; por lo tanto, las gammaproteobacterias en el agua de mar ambiental probablemente se originan en peces.
Además, nuestra comparación de los datos del microbioma con los datos del transcriptoma y el metaboloma indicó que la fluctuación microbiana después del aporte nutricional es más significativa que el metabolismo del huésped. Finalmente, un análisis exhaustivo del microbioma y el metabolismo del huésped podría identificar factores clave para monitorear el ambiente acuícola y el metabolismo simbiótico durante la alimentación (Fig. 3).
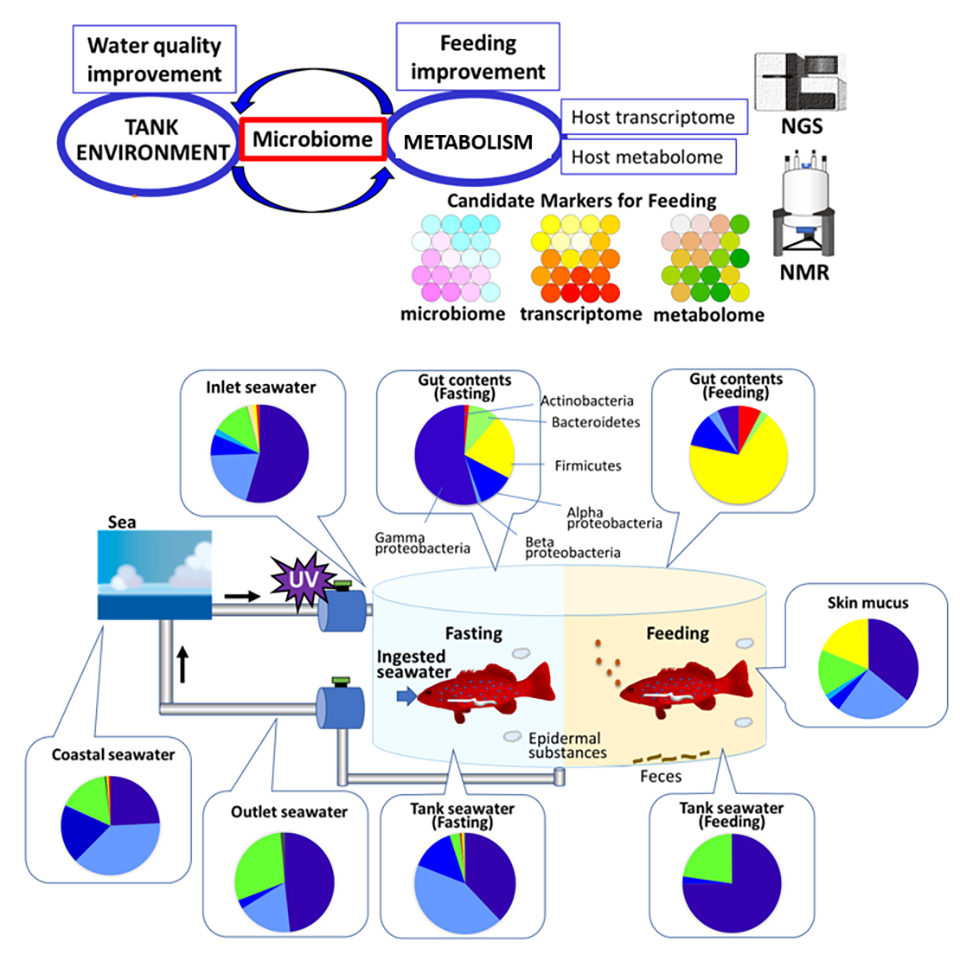
Perspectivas
Los resultados de nuestro estudio mostraron que la composición de la microbiota cambió en respuesta a las condiciones de alimentación y ayuno, y podría afectar el control nutricional y el equilibrio energético. El ciclo de alimentación y ayuno involucra el metabolismo del huésped y está relacionado con la obesidad y las enfermedades metabólicas. En este estudio, la composición de la microbiota de peces cambió drásticamente dentro de los dos días posteriores a los ciclos de alimentación y ayuno. Como la microbiota intestinal influye en el metabolismo del pez huésped, dilucidar la relación entre la microbiota intestinal y el pez huésped podría resultar crucial para la producción exitosa y eficiente de peces cultivados.
La microbiota de los peces puede indicar la condición de sus metabolismos y de sus sistema s inmunitarios. El agua de mar ambiental afecta directamente las condiciones de los peces; por lo tanto, el monitoreo de la microbiota en el agua de mar ambiental también es importante para mantener la salud de los peces. El control de la microbiota constituye un enfoque para garantizar una acuacultura exitosa.
Ahora que Ud. ha terminado de leer el artículo ...
… esperamos que considere apoyar nuestra misión de documentar la evolución de la industria de acuícola global y compartir nuestra vasta red de conocimiento en expansión de los contribuyentes cada semana.
Al convertirse en miembro de la Global Aquaculture Alliance, se asegura de que todo el trabajo pre-competitivo que realizamos a través de los beneficios, recursos y eventos de los miembros (la Academia, The Advocate, GAA Films, GOAL, MyGAA) pueda continuar. Una membresía individual cuesta solo $ 50 al año.
Authors
-
Miyuki Mekuchi
RIKEN Center for Sustainable Resource Science
Tsurumi-ku, Yokohama, Kanagawa, Japan; and National Fishery Research Institute of Fishery Sciences Fishery Research and Education Organization
Kanazawa-ku, Yokohama, Japan -
Taiga Asakura, Ph.D.
RIKEN Center for Sustainable Resource Science
Tsurumi-ku, Yokohama, Kanagawa, Japan -
Kenji Sakata
RIKEN Center for Sustainable Resource Science
Tsurumi-ku, Yokohama, Kanagawa, Japan -
Dr. Tomofumi Yamaguchi
Research Center for Subtropical Fisheries
Ishigaki, Japan -
Dr. Kazuhisa Teruya
Research Center for Subtropical Fisheries
Ishigaki, Japan -
Jun Kikuchi, Ph.D.
Corresponding author
RIKEN Center for Sustainable Resource Science, Tsurumi-ku, Yokohama, Kanagawa, Japan;
and Graduate School of Medical Life Science, Yokohama City University, Tsurumi-ku, Yokohama, Kanagawa, Japan;and Graduate School of Bioagricultural Sciences, Nagoya University, Chikusa-ku, Nagoya, Aichi, Japan[112,106,46,110,101,107,105,114,64,105,104,99,117,107,105,107,46,110,117,106]
Tagged With
Related Posts

Aquafeeds
Consideraciones para ingredientes alternativos en alimentos acuícolas
Una clave para expandir la acuacultura es encontrar fuentes alternativas de proteínas y aceites. La suplementación o sustitución de aceite de pescado en los alimentos acuícolas con fuentes alternativas de lípidos – semillas oleaginosas, microalgas, insectos y otros - parece posible si se pueden satisfacer los requisitos de ácidos grasos esenciales.

Responsibility
Optimización de sistemas de tecnología biofloc de tilapia, parte 1
Chambo Fisheries, la granja de tanques de biofloc de tilapia más grande del mundo y la granja de tanques más grande de África, tiene un programa de producción secuencial multi-cohorte continua.

Aquafeeds
¿Sacudirán los percebes a los alimentos vivos para la acuacultura?
La empresa emergente noruega Planktonic AS cree que ha encontrado una alternativa viable a las dietas tradicionales en forma de nauplios de percebes.

Aquafeeds
Producción de tilapia enriquecida con omega-3 a través de dieta de harina de algas o aceite de pescado
Este estudio evaluó el efecto de las dietas suplementadas con aceite de pescado y harina de algas para el enriquecimiento de LC-PUFA en tilapia juvenil del Nilo. Las dietas experimentales son prometedoras como una opción viable para enriquecer el contenido de omega-3 en los filetes de tilapia.


