Dos décadas de estudio en camarones, mecanismos de defensa viral de insectos abren el camino para la producción de vacunas y la inmunidad anti-viral hereditaria

Este artículo contiene noticias de última hora de un descubrimiento que debería ayudarnos a diseñar nuevas vacunas de camarón y adaptar las poblaciones de camarón libres de patógenos específicos (SPF) para tolerar todos los principales virus del camarón. Desde el principio, debo dejar muy claro que los virus a los que me refiero son problemáticos solo para el camarón y para los productores de camarón cuya producción de camarón puede verse afectada negativamente por ellos. Estos virus no infectan a los vertebrados, incluidos los humanos, por lo que no representan una amenaza para la salud humana o animal, excepto para los camarones y quizás
En 1998, mi alumno Tirasak Pasharawipas (ahora profesor en el Departamento de Ciencias Médicas de la Universidad de Rangsit en Tailandia) y yo formulamos una propuesta según la cual los camarones y los insectos se defendían de los virus tolerándolos en lugar de eliminarlos. Llamamos al fenómeno “acomodación viral.” Aunque pocas personas estuvieron de acuerdo con nosotros en ese momento, nuestro grupo de investigación en el Centex Shrimp persistió con nuestra investigación y demostró que los camarones y los insectos pueden albergar uno o más virus durante toda la vida sin efectos negativos. Sin embargo, no conocíamos el mecanismo subyacente que lo hizo posible. Todo lo que sabíamos era que los camarones no tenían anticuerpos y que algo más debía estar funcionando.
Luego, en 2009, tuve mi “momento eureka” basado en evidencia dispersa y formulé la hipótesis de un nuevo mecanismo por el cual los camarones y los insectos podrían usar ADN y ARN en lugar de anticuerpos para defenderse contra patógenos virales (Flegel, T.W., 2009. Hypothesis for heritable, anti-viral immunity in crustaceans and insects. Biology Direct. 4, 32; doi: 10.1186/1745-6150-4-36). La Figura 1 ilustra la hipótesis de 2009 sobre los mecanismos subyacentes al fenómeno de la acomodación viral. Sugerí varias formas de probar esta hipótesis con resultados previstos que apoyarían o contrarrestarían la hipótesis.
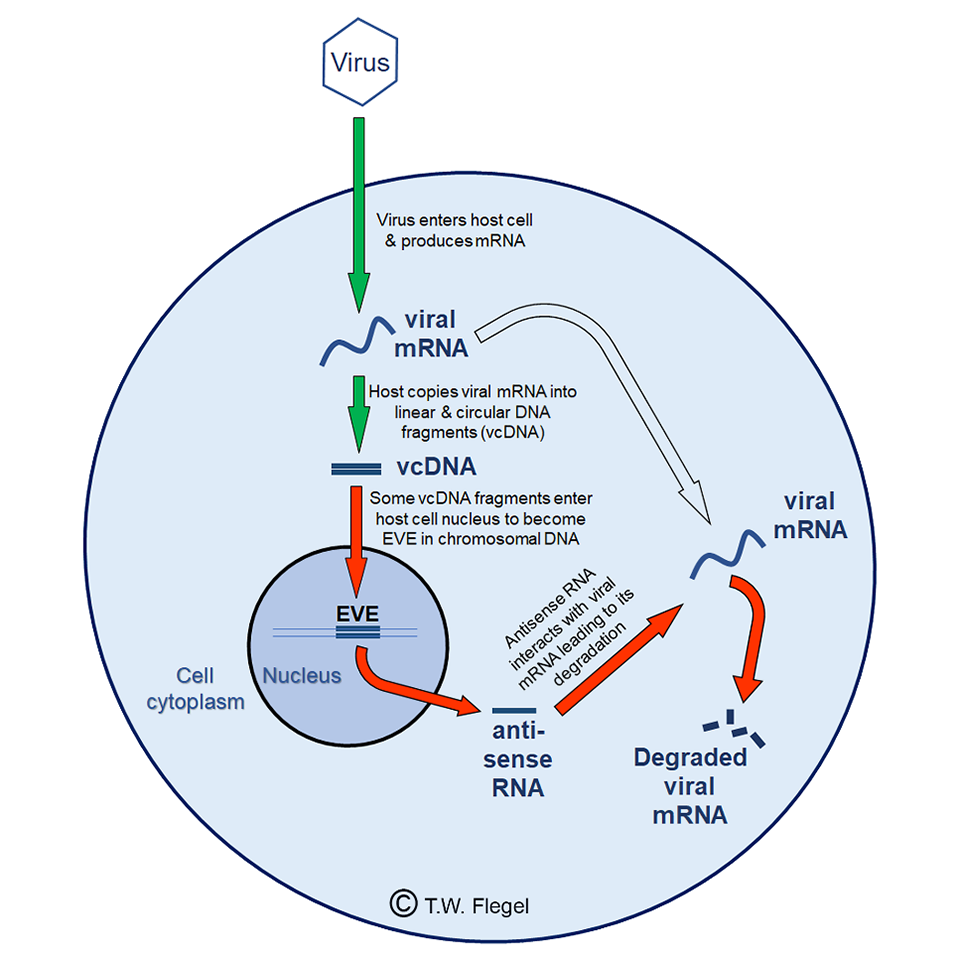
Científicos en Francia (el grupo de la Dra. Maria Carla Saleh en el Instituto Pasteur, París, Francia) y en los Estados Unidos (el grupo del Dr. Raul Andino en la Universidad de California, San Francisco, Calif., EE. UU.) trabajando con insectos (moscas de la fruta y mosquitos) entre 2013 y 2020, demostraron que los elementos clave de la hipótesis de 2009 eran correctos para varios virus de ARN. Básicamente, para acomodar los virus, los camarones y los insectos copian fragmentos de ARN viral en el ADN e insertan las copias de ADN en su propio genoma. Estos fragmentos de copia se denominan EVE (elementos virales endógenos) que producen ARN antisentido [un ARN monocatenario que es complementario a un ARN mensajero (ARNm) que codifica una proteína con el que se hibrida y, por lo tanto, bloquea su traducción a proteína]. El ARN antisentido conduce a la degradación del ARNm viral, lo que mantiene al virus bajo control. Si el EVE se presenta en óvulos o espermatozoides, se transmiten a la siguiente generación. Esta es una gran ventaja sobre los anticuerpos que no se pueden transmitir a la descendencia.
Un resultado sorprendente de la investigación sobre insectos en Francia fue que los fragmentos de ADN copiados del ARN viral se presentaban tanto en formas lineales como circulares. Esto no se predijo en mi hipótesis de 2009 en la que imaginé solo copias lineales de ADN. El informe francés describió cómo la copia viral circular de ADN (cvcADN) podría extraerse específicamente de los insectos, y cómo la inyección del extracto de cvcADN podría proteger a los mosquitos ingenuos de la muerte tras la exposición viral. Estaba muy emocionado con estos resultados porque el ADN circular es muy estable y sugirió que el cvcADN tenía el potencial de servir como una vacuna viral de camarón que podría sobrevivir al procesamiento de alimentos para administración oral. Aunque todo el trabajo de los insectos se realizó con virus de ARN, planteamos la hipótesis, basándonos en mi hipótesis de 2009, que el ARNm de los virus de ADN también podría servir como objetivo para la producción de cvcADN.
Debería ser posible desarrollar poblaciones de camarón tolerantes a todos los virus principales.
En los últimos meses, nuestro grupo en Tailandia ha podido seguir los protocolos de insectos para extraer cvcADN de camarones infectados con un virus de ADN y demostrar que puede proteger a los camarones ingenuos contra ese virus. Específicamente, usamos camarón tigre negro (Penaeus monodon) infectado con IHHNV (Virus Infeccioso Hipodérmico y Hematopoyético, recientemente rebautizado como Penstylhamaparvovirus 1). Pudimos extraer IHHNV-cvcADN del camarón infectado e inyectarlo en el camarón blanco del Pacífico (Penaeus vannamei), donde impidió la replicación del IHHNV. Una preimpresión de este trabajo ya está disponible en línea en el sitio web de BioRxiv para aquellos que estén interesados en los detalles. Los resultados de este trabajo abren el camino para el posible desarrollo de vacunas cvcADN para camarones.
Cuando el extracto de cvcADN que obtuvimos de P. monodon infectado por IHHNV se envió para la secuenciación de próxima generación, NGS [una tecnología de secuenciación de ADN que revolucionó la investigación genómica, reduciendo significativamente el tiempo necesario para secuenciar genomas], pudimos demostrar que el extracto contenía una variedad de tipos de cvcADN que se originaron a partir del IHHNV. Esto proporcionó la confirmación final de que los camarones infectados con IHHNV podrían producir cvcADN, de manera similar a los insectos infectados con virus ARN.
Sin embargo, también hicimos el descubrimiento muy sorprendente de que algunas de las secuencias de cvcADN en nuestro extracto provenían de un EVE que había sido descrito previamente de P. monodon en Madagascar como “IHHNV no infeccioso” por el grupo del profesor Don Lightner en 2006. Estos resultados se incluyen en la preimpresión en el sitio web de BioRxiv mencionado anteriormente. Algunos de estos tipos inesperados de cvcADN incluían IHHNV y secuencias de genes del huésped unidas entre sí, lo que confirma su origen en el genoma del camarón huésped. Encontramos esto aún más emocionante, porque indicó que los extractos de cvcADN de camarones podrían usarse para filtrar camarones para detectar la presencia de EVE.
Como se indicó anteriormente, los científicos estadounidenses y franceses que trabajan con insectos han demostrado que algunos EVE producen ARN antisentido que puede proteger contra enfermedades causadas por el virus homólogo. A estos los llamo EVE-protectores. Ya habíamos probado en 2011 y 2017 que EVE con identidad de secuencia alta para IHHNV y WSSV existentes ocurrió en camarones y podría ser heredado. Sin embargo, no teníamos ninguna forma de determinar fácilmente qué camarones portaban EVE para un virus en particular o si el EVE era protector. Ahora, parece que tenemos una manera fácil de hacer esto simplemente secuenciando extractos de cvcADN de camarones aparentemente no infectados.
Ya hemos comenzado a seleccionar muestras de reproductores de poblaciones individuales de P. monodon y P. vannamei SPF para detectar la presencia de EVE de los virus del camarón mediante la secuenciación de su cvcADN. Por ejemplo, estamos evaluando el WSSV-EVE en poblaciones SPF que incluyen camarones fundadores negativos al WSSV que surgieron de antepasados con probable exposición a los tipos existentes de WSSV.
Cualquiera puede hacer este tipo de experimento. Los descubrimientos de que el cvcADN surge de la infección viral del camarón o se origina en EVE son simplemente revelaciones de fenómenos naturales. Por lo tanto, no son patentables y cualquiera es libre de buscar aplicaciones basadas en estos descubrimientos. Los productores de reproductores de camarón pueden aprovechar de inmediato la extracción y secuenciación del cvcADN para seleccionar sus poblaciones en busca de un EVE potencialmente protector. Una vez identificados, pueden seguir y preservar esos EVE en sus programas de reproducción simplemente usando métodos de la reacción en cadena de la polimerasa [PCR, una técnica ampliamente utilizada para hacer rápidamente de millones a miles de millones de copias de una muestra de ADN específica, donde los científicos pueden usar una muestra muy pequeña de ADN y amplificarlo (o una parte de él) a una cantidad lo suficientemente grande como para estudiar en detalle]. De esta manera, creemos que debería ser posible desarrollar poblaciones de camarón tolerantes a todos los virus principales.
Además, es posible que el cvcADN protector que surge de EVE o de infecciones virales pueda desarrollarse en vacunas de camarón producidas por PCR para uso en criaderos y estanques de engorde. También podrían usarse para inyectarlos en los ovarios de reproductores domesticados para dar lugar a EVE hereditario y protector en su descendencia. Esta tecnología también debería aplicarse a insectos domesticados como gusanos de seda y abejas. Es cierto que la descendencia constituiría organismos transgénicos, pero los procesos por los que surgen son naturales y ya ocurren en la naturaleza. Básicamente, simplemente estaríamos seleccionando el más efectivo de los EVE ya existentes y asegurándonos de que estén presentes en nuestras poblaciones de cría.
Esencialmente camarones, insectos y quizás otros invertebrados han estado interactuando con virus de esta manera utilizando antiguos mecanismos naturales para la modificación genética autónoma (AGMO). Técnicamente hablando, esto significa que son organismos transgénicos naturales (NTO) con los que la humanidad ha estado interactuando durante milenios sin efectos negativos. Sus construcciones de cvcADN consisten en ADN desnudo que no es replicativo, por lo que no pueden aumentar independientemente en número y propagarse como los virus de los que se originan.
Este sistema animal AGMO para interactuar con virus es anterior a un sistema AGMO algo similar (es decir, el conocido mecanismo CRISPR, una tecnología que puede usarse para editar genes) que probablemente fue usado por las arqueobacterias [los organismos vivos más antiguos de la tierra] y eubacterias [las bacterias “verdaderas,” microorganismos procariotas unicelulares (normalmente un organismo unicelular sin un núcleo encerrado en una membrana nuclear) – incluye todos los tipos de bacterias excepto las arqueobacterias] para controlar sus patógenos virales (bacteriófagos; virus que infectan y se replican dentro todas las bacterias) incluso antes de la existencia de protozoos. Por lo tanto, AGMO y NTO son mucho más comunes de lo que se pensaba anteriormente, y no hay necesidad de temer a esta tecnología.
Now that you've reached the end of the article ...
… please consider supporting GSA’s mission to advance responsible seafood practices through education, advocacy and third-party assurances. The Advocate aims to document the evolution of responsible seafood practices and share the expansive knowledge of our vast network of contributors.
By becoming a Global Seafood Alliance member, you’re ensuring that all of the pre-competitive work we do through member benefits, resources and events can continue. Individual membership costs just $50 a year.
Not a GSA member? Join us.
Author
-

Timothy W. Flegel, Ph.D.
Center of Excellence for Shrimp Molecular Biology and Biotechnology (Centex Shrimp)
Faculty of Science
Mahidol University
Rama VI Road, Bangkok 10400, Thailand; and
National Center for Genetic Engineering and Biotechnology (BIOTEC)
National Science and Technology Development Agency (NSTDA)
Thailand Science Park
Pathum Thani, 12120 Thailand[109,111,99,46,108,105,97,109,103,64,108,101,103,101,108,102,46,109,105,116]

