Conocer las características únicas del agua es importante para la gestión de la calidad en la acuacultura

El agua es el medio para la acuacultura, y la mayoría de mis columnas han sido acerca de la calidad del agua y sus efectos en los animales acuáticos cultivados. Las propiedades físicas del agua son únicas y afectan en gran medida el comportamiento del agua en la naturaleza y en los sistemas acuícolas. La mayoría de los acuicultores dedican un esfuerzo considerable a mantener una calidad de agua adecuada en los sistemas de cultivo. Muchos pueden haber pasado por alto o olvidado la singularidad del agua y cómo sus propiedades básicas influyen en los sistemas acuícolas.
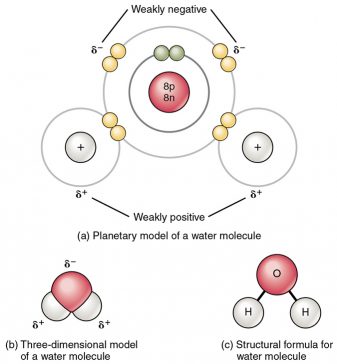
El agua pura a temperatura ambiente es un líquido transparente, inodoro e incoloro de moléculas simples, cada una de las cuales consta de dos átomos de hidrógeno y un átomo de oxígeno. La disposición única de estos átomos en el agua impacta una carga negativa pequeña a un lado de su molécula y una carga positiva en dos sitios en el otro lado. Los sitios cargados positivamente en moléculas de agua atraen los sitios cargados negativamente de otra molécula de agua para formar enlaces conocidos como enlaces de hidrógeno.
Debido al enlace de hidrógeno, la fuerza de atracción entre las moléculas de agua es mucho mayor de lo que cabría esperar, y esta atracción entre las moléculas de agua imparte propiedades únicas, casi mágicas, al agua.
Propiedades térmicas
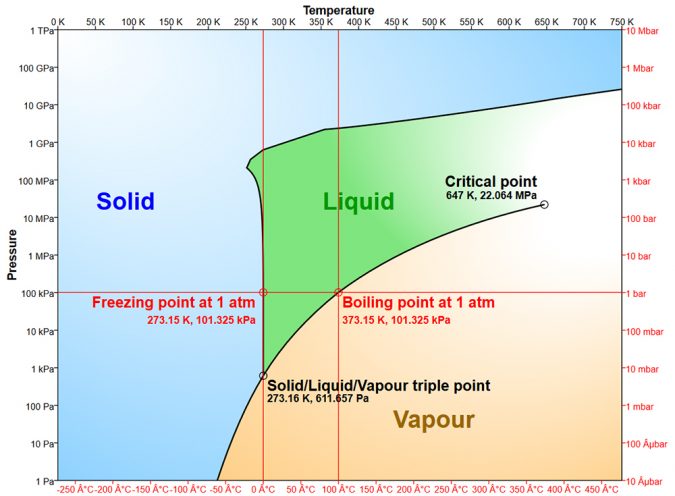
Los puntos de congelación y ebullición, 0 grados C y 100 grados C, respectivamente, de agua a presión atmosférica normal son mucho más altos que los de otros compuestos de hidrógeno de bajo peso molecular. El agua se congela cuando su contenido de energía disminuye y el movimiento molecular se vuelve más lento de modo que los enlaces de hidrógeno se forman para producir la estructura cristalina del hielo. El hielo se derrite cuando su contenido de energía aumenta, el movimiento molecular aumenta y rompe suficientes enlaces de hidrógeno para hacer que la estructura cristalina del hielo se colapse.
En el punto de congelación, 80 calorías de calor deben ser removidas de o agregadas a cada gramo de agua para hacer que cambie de fase – para que se congele o derrita sin cambios de temperatura. Una vez derretida, sólo se necesita 1 caloría por gramo de agua para aumentar la temperatura en 1 grado-C. La capacidad de retención de calor del agua es alta en comparación con otras sustancias que se encuentran en el medio.
El espaciamiento de las moléculas en el enrejado cristalino de hielo crea un vacío, y un volumen de hielo pesa alrededor de un onceavo menos que el mismo volumen de agua líquida, lo que permite que el hielo flote. Esto evita que los cuerpos de agua se congelen sólidos en climas fríos. La gravedad específica del agua aumenta a medida que la temperatura aumenta hasta que la densidad máxima de 1,000 se alcanza a unos 39 grados F (4 grados C). Un calentamiento adicional disminuye la gravedad específica del agua.
El contenido mineral disuelto o salinidad también influencia la gravedad específica del agua. El agua más fría es ligeramente más pesada que el agua más caliente, y el agua de mar es ligeramente más pesada que el agua dulce. Las diferencias de densidad (peso / volumen) causadas por la temperatura permiten que los cuerpos de agua dulce se estratifiquen, y las diferencias de salinidad pueden hacer que los cuerpos de agua salados se estratifiquen.
El agua cambia de líquido a vapor cuando alcanza suficiente energía interna y movimiento molecular para romper todos los enlaces de hidrógeno. El vapor de agua se condensa para formar agua líquida cuando pierde energía y el movimiento molecular disminuye para permitir la formación de enlaces de hidrógeno. La cantidad de energía necesaria para cambiar el líquido a vapor (o viceversa) en el punto de ebullición es de 540 calorías por gramo.
Sin embargo, el agua no tiene que alcanzar los 100 grados C para evaporarse. A temperaturas más bajas, el agua cambia de líquido a vapor de agua porque algunas moléculas de agua tienen más energía que otras y escapan de la superficie para evaporarse. Este hecho no cambia los requerimientos energéticos para evaporar el agua.
Vapor de agua
Si una superficie de agua es expuesta a aire seco, las moléculas de agua entran en el aire hasta que está saturado. La presión de las moléculas de agua en el aire que actúa hacia abajo sobre la superficie del agua es la presión de vapor del agua. La presión de vapor aumenta a medida que la temperatura aumenta, y cuando se convierte en igual a la presión atmosférica, se forman burbujas y empujan la atmósfera – y el agua hierve.
La humedad relativa del aire es el porcentaje de la capacidad de retención de humedad del aire que se llena con vapor de agua en un momento determinado. La baja humedad relativa favorece la evaporación. La disminución de la temperatura del aire aumentará la humedad relativa y viceversa. Cuando el aire alcanza el 100 por ciento de humedad relativa, ocurrirá la condensación del vapor de agua contenido en él. Las nubes resultan cuando el aire sube, se enfría, se satura con vapor de agua y se produce condensación. Las gotas de humedad de las nubes pueden crecer hasta que son lo suficientemente pesadas como para caer como lluvia o precipitación congelada.
Agua y superficies
Las moléculas de agua son cohesivas cuando forman enlaces de hidrógeno entre sí, pero son adhesivas cuando forman enlaces de hidrógeno con moléculas de otras sustancias. El agua se adhiere a una superficie sólida si sus moléculas tienen una mayor tendencia a formar enlaces de hidrógeno con la superficie que con otras moléculas de agua – tal superficie se llama hidrofílica porque se moja fácilmente.
Las fuerzas cohesivas entre las moléculas de agua pueden tender a ser mayores que la atracción de moléculas de agua a una superficie sólida; el agua saldrá como gotitas de tal superficie y no la mojará – tal superficie se llama hidrofóbica. Por ejemplo, la madera cruda se moja fácilmente, pero una capa de pintura hará que la madera libere agua. Si la adherencia es mayor que la cohesión, la superficie es hidrófoba.
Las moléculas de agua en una superficie de agua están sometidas a una fuerza cohesiva hacia dentro de las moléculas por debajo de la superficie, pero no hay tal atracción por encima de la superficie. Esto causa que las moléculas superficiales actúen como una piel, un fenómeno conocido como tensión superficial. La tensión superficial es lo suficientemente fuerte como para permitir que ciertos insectos y arañas caminen sobre la superficie del agua, y permitir que floten las agujas y las hojillas de afeitar.
A medida que la adhesión arrastra la película superficial hacia arriba, la película superficial – debido a la cohesión a las moléculas debajo – hala el agua hacia arriba del tubo contra la fuerza de la gravedad. La altura que el agua sube en un tubo delgado es inversamente proporcional al diámetro del tubo. En el suelo, el espacio abierto existe porque las partículas del suelo no encajan perfectamente. El espacio de poros interconectado en el suelo funciona de la misma manera que un tubo capilar, permitiendo que el agua se eleve por encima de la capa freática en un suelo seco. Por lo tanto, los suelos inferiores en estanques vacíos donde la capa freática está cerca del fondo del estanque no pueden secarse completamente.
El agua tiene poca o ninguna elasticidad de forma y se ajusta a la forma de su envase. A menos que esté completamente confinada, el agua tiene una superficie libre que está horizontal excepto en los bordes. La presión del agua en un recipiente es igual al peso del agua que presiona hacia abajo en el fondo; por lo tanto, en la práctica la presión del agua se da a menudo en términos de profundidad del agua y se llama la cabeza.
Como todo el mundo sabe, el agua fluye cuesta abajo, desde la cabeza más alta hasta la cabeza más baja. El agua tiene viscosidad o resistencia interna al flujo resultante de la cohesión entre moléculas de agua, intercambio de partículas entre capas de diferentes velocidades y fricción entre las superficies sólida y fluida. En el flujo laminar, el agua se mueve en capas con poco intercambio de moléculas entre capas. Cuando el flujo se vuelve turbulento, las moléculas ya no fluyen en capas y el movimiento del agua se vuelve más complejo.
Agua como disolvente
Los cristales de sal mantienen su estructura en el aire debido a la atracción eléctrica entre sus iones componentes. Por ejemplo, un cristal de sal de mesa – cloruro de sodio – está compuesto de iones de sodio positivos y iones de cloruro negativos atraídos entre sí. La sal se disuelve fácilmente en agua porque las fuerzas atractivas entre los iones negativos y los iones positivos son menores en el agua que en el aire.
Los iones negativos atraen los sitios positivos en varias moléculas de agua, y los iones positivos atraen los sitios negativos de otras moléculas de agua – un proceso llamado hidratación. Esta atracción de las moléculas de agua aísla las cargas sobre los iones y disminuye el grado de atracción entre ellos. Así, el agua es un disolvente excelente para la mayoría de las sales inorgánicas y muchas sustancias orgánicas.
La conductividad es la capacidad de una sustancia para transmitir una corriente eléctrica. En el agua, la corriente eléctrica es transportada por los iones disueltos. El agua pura no conduce la electricidad bien, porque contiene solamente algunos iones de hidrógeno e hidróxido.
Las aguas naturales, sin embargo, contienen más iones disueltos, y conducen la electricidad muy bien. La conductividad aumenta en proporción directa a las concentraciones de iones disueltos, y proporciona una forma simple de estimar las concentraciones de iones (salinidad del agua). Esta medición se utiliza a menudo en la acuacultura.

Luz y turbidez
Parte de la luz del sol que llega los cuerpos de agua naturales no penetra la superficie. Una parte de la luz se refleja, y la cantidad depende de la rugosidad de la superficie del agua y el ángulo de los rayos del sol. Cuanto más lisa sea la superficie y más cerca de la vertical los rayos solares, mayor será el porcentaje de luz que penetre la superficie del agua.
En agua pura, aproximadamente el 50 por ciento de la luz incidente se transforma en calor dentro del primer metro de profundidad. Las aguas naturales contienen sustancias que interfieren aún más con la penetración de la luz. El color del agua natural resulta de los rayos de luz no absorbidos que quedan de la luz original.
Las sustancias en solución o en suspensión coloidal causan color verdadero en agua. El color aparente es causado por la materia suspendida que interfiere con la penetración de la luz. Durante el día, la fotosíntesis de las plantas acuáticas aumenta a medida que la luz aumenta y disminuye a medida que disminuye la luz. Las nubes pueden reducir la cantidad de luz solar que llega las superficies de agua e inmediatamente reducen la tasa de fotosíntesis.
La turbidez se refiere a la disminución de la capacidad del agua para transmitir la luz, causada por material particulada en suspensión, generalmente partículas del suelo, plantas vivas y animales diminutos, y animales (plancton) y partículas de plancton en descomposición u otros restos orgánicos. Una cierta cantidad de turbidez causada por el fitoplancton es deseable en los estanques acuícolas porque evita que la luz llegue al fondo y fomente las malas hierbas bajo el agua. La alta concentración de turbidez debida a partículas de arcilla suspendidas disminuye la tasa de fotosíntesis.

Estratificación térmica
La temperatura del agua sigue de cerca la temperatura del aire en los estanques, y cambia marcadamente con la estación. Al final del invierno, la columna de agua en un lago o estanque tiene una temperatura y densidad relativamente uniformes. Aunque el calor es absorbido en la superficie en días soleados, hay poca resistencia a la mezcla por el viento y todo el volumen del cuerpo de agua circula y se calienta uniformemente. A medida que la primavera progresa, el estrato superior se calienta más rápidamente que el calor se distribuye desde el estrato superior hasta el estrato inferior por mezclado.
Las aguas del estrato superior se hacen mucho más cálidas y ligeras que las del estrato inferior. Si el estanque tiene más de 2 a 3 metros de profundidad máxima, los vientos que normalmente disminuyen en velocidad a medida que el clima se calienta ya no son lo suficientemente fuertes como para mezclar los dos estratos debido a la diferencia de densidad.
El estrato superior se llama el epilimnion y el estrato inferior el hipolimnion. El estrato entre el epilimnio y el hipolimnio tiene un marcado diferencial de temperatura. Esta capa se denomina termoclina. En los trópicos, los estanques profundos generalmente se estratifican en la estación seca y se destratifican en la estación húmeda, o pueden permanecer estratificados durante todo el año.
Los estanques acuícolas no deben ser más profundos de 2 metros para evitar la estratificación térmica. Por supuesto, la aireación mecánica mezcla el agua del estanque y puede prevenir la estratificación incluso en estanques algo más profundos.
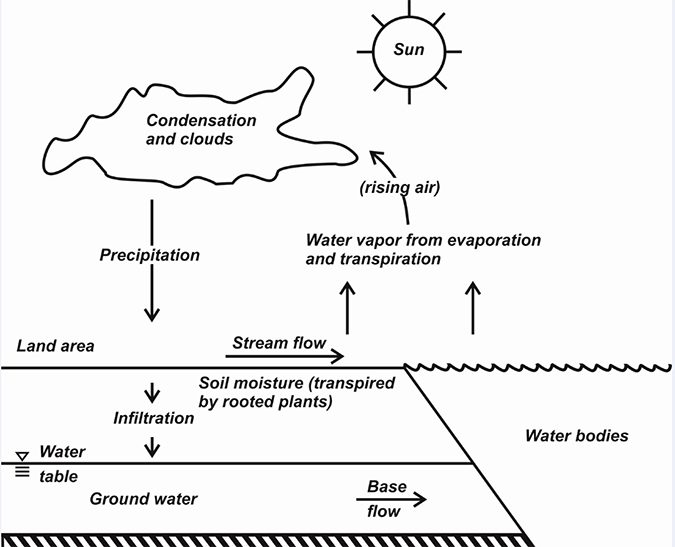
El ciclo hidrológico
El movimiento familiar y continuo del agua de la tierra en el ciclo hidrológico se representa en la Fig. 3. Este ciclo ha sido reconocido desde hace mucho tiempo. Un pasaje del Antiguo Testamento se refiere a los ríos que fluyen hacia el océano, pero que el océano no está lleno. El agua se evapora del océano, de los lagos, de los estanques y de las corrientes y de la tierra húmeda; El agua también es transpirada por las plantas.
El sol proporciona energía para cambiar el agua líquida a vapor de agua, por lo que la radiación solar es el motor que impulsa el ciclo hidrológico. El vapor de agua está atrapado en la circulación atmosférica general, y en lugares donde se eleva y enfría el aire, el vapor de agua se condensa en agua sólida o líquida y se devuelve a la superficie de la tierra como rocío, helada, aguanieve, nieve, granizo o lluvia.
Una parte del agua que llega a la superficie de la tierra se evapora de nuevo a la atmósfera casi de inmediato, pero otra parte corre sobre la superficie de la tierra como escorrentía de tormenta, se recoge en arroyos, ríos y lagos, y finalmente entra en el océano. El agua se evapora continuamente cuando la escorrentía fluye hacia los océanos, y se evapora continuamente del océano.
Algún agua se infiltra en el suelo y se convierte en agua del suelo o alcanza capas saturadas para entrar en los acuíferos de las aguas subterráneas. El agua del suelo puede ser devuelta a la atmósfera por la transpiración de las plantas. El agua subterránea se filtra a arroyos, lagos y el océano, y puede ser removida por los pozos para su uso por la humanidad – con frecuencia para la acuacultura.
La filtración y la evaporación de los estanques determinan la cantidad de agua que se debe agregar para mantener los niveles de agua en los estanques. Además, si los estanques son de alimentados por la lluvia, la escorrentía de la cuenca es la fuente de agua, y la relación entre el área de la cuenca y el volumen del estanque y las tasas de infiltración y evaporación es crítica. Por lo tanto, los acuacultores deben estar familiarizados con los ciclos hidrológicos locales y su variación entre estaciones y años.
Author
-

Claude E. Boyd, Ph.D.
School of Fisheries, Aquaculture and Aquatic Sciences
Auburn University
Auburn, AL 36830 USA
[117,100,101,46,110,114,117,98,117,97,64,49,101,99,100,121,111,98]
Tagged With
Related Posts

Aquafeeds
Estudiando el crecimiento de camarón en diferentes sistemas de biofloc
Un estudio llevado a cabo con camarones juveniles (Litopenaeus vannamei) criados en sistemas experimentales de biofloc utilizó cuatro tratamientos. Los resultados indican que las diferencias en la gestión y la fuente de carbohidratos pueden llevar a disparidades sustanciales en el funcionamiento y la producción del sistema.

Health & Welfare
Probando un sistema intensivo de criadero de camarones con tecnología biofloc
El uso de la tecnología de biofloc (BFT) está aumentando en la producción comercial de varias especies acuáticas importantes, ya que puede aumentar la producción y la eficiencia y minimizar los posibles impactos de los efluentes. Este estudio mostró que los sistemas BFT sin recambio de agua y suplementados con melaza o dextrosa como fuente de carbono producen un rendimiento y calidad de agua adecuados durante la fase de criadero de L. vannamei.

Innovation & Investment
El ojo en el cielo: Europa emplea satélites para avanzar la acuacultura
Copernicus, el Sistema de Observación de la Tierra de 4.300 millones de euros de la Agencia Espacial Europea, tiene beneficios potenciales para la pesca y la acuacultura. El proyecto SAFI se está acercando al sector acuícola en relación al aprovechamiento y el monetizado de este servicio único desde allá arriba.

Responsibility
Abordando la inocuidad en la cadena de suministro de tilapia de América Latina
En la última década, la experiencia adquirida por muchos productores de tilapia combinada con programas eficaces implementados por los gobiernos locales ha mejorado significativamente la producción de tilapia en varios países de América Latina como Colombia, México, Ecuador y otros importantes productores de tilapia de la región.

